توضیحات محصول
دانلود پاورپوینت الکتروشیمی تحلیلی با فرمت ppt ودر 64 اسلاید قابل ویرایش
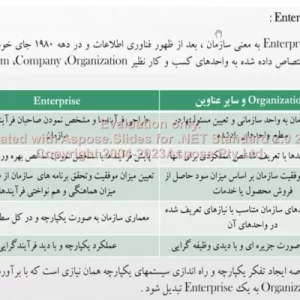
قسمتی از متن پاورپوینت الکتروشیمی تحلیلی
واکنش الکتروشيميايی
واکنش الکتروشيميايی در حقيقت واکنش انتقال الکترون است
دو نوع واکنش انتقال الکترون وجود دارد:
انتقال الکترون در داخل محلول يا هموژن
solution electron transfer or Homogeneous electron transfer
vانتقال الکترون در خارج محلول يا هتروژن (در واقع انتقال الکترون درسطح الکترود بين دو سطح هتروژن رخ می دهد.)
Heterogeneous electron transfer
¢واکنش های انتقال الکترون در سطح الکترود، به دو دسته تقسيم می شوند:
.1واکنش های احیائی
.2واکنش های اکسیدی
آشنايي با برخی تعاريف در الکتروشيمي
¢شرط انجام اکسيداسيون:
زمانی مي توان يک گونه را در سطح الکترود اکسيد کرد که Eapp > E* باشد.
¢شرط انجام احياء:
زمانی می توان يک گونه را در سطح الکترود احياء کرد که Eapp
¢سل مصنوعی (Dummy Cell):
سطح مشترک الکترود-محلول در محلول همانند يک خازن عملمي کند و محلول الکتروليت هم مشابه يک مقاومت رفتار می کند، بنابراين يک سل الکتروشيميايي مجموعه ای از يک خازن و يک مقاومت است. با استناد به اين اصل در دستگاه های الکتروشيمي يک سل مصنوعی مشابه با يک سل الکتروشيميايي طراحی شده است. اين سل مي تواند internal و يا external باشد.
ابزارهای الکترونيکی
¢دستگاه های passive: دستگاه هايی هستند که جهت حرکت الکترونها را تغيير نمی دهند مثل آمپرومتر و پتانسيومتر
¢دستگاه های active: اين دستگاه ها می توانند جهت حرکت الکترون ها را تغيير بدهند يا به عبارتی نقش آند و کاتد را معکوس می کنند. مثل پتانسيواستات يا گالوانواستات
انواع اندازه گيری های متداول درالکتروشيمی تجزيه ای
¢اندازه گيری های پتانسيومتری: پتانسيل بين دو الکترود شاهد و شناساگر توسط يک پتانسيومتر سنجيده مي شود
¢اندازه گيری های گالوانواستاتيک: اعمال جريان ثابت و اندازه گيری پتانسيل.
¢ ثابت بودن جريان دو حالت دارد:
vجريان در طول زمان ثابت است (کرونوپتانسيومتری)
vجريان در يک بازه زمانی ثابت است و با يک برنامه خاص تغيير می کند.
¢اندازه گيری های پتانسيواستاتيک: اعمال پتانسيل ثابت و اندازه گيری شدت جريان.
¢ ثابت بودن پتانسيل دو معنی دارد:
vپتانسيل در طول زمان ثابت است (کرونوآمپرومتری)
vپتانسيل در يک بازه زمانی ثابت است و با يک برنامه خاص تغيير می کند.
مقايسه پتانسيومتری و ولتامتری
¢در صورتی می توان از رابطه نرنست برای محاسبه پتانسيل الکترود استفاده کرد که، غلظت گونه ها در توده محلول و در سطح الکترود متفاوت نبوده و يا اختلاف آنها ناچیز باشد. به عبارت بهتر جريان بايد صفر و يا خيلی کم باشد. لذا برای پتانسيومتری می توان از غلظت در توده محلول در رابطه نرنست استفاده کرد، ولی در ولتامتری بايد غلظت گونه ها در سطح الکترود، در رابطه نرنست اعمال گردد.
¢در سل های ولتامتری پتانسيل الکترود کار نسبت به الکترود شاهد اندازه گيری می شود واين پتانسيل بايد تا حد امکان خالص باشد و IR در آن دخيل نباشد، برای اين منظور:
vسل ولتامتری به گونه ای طراحی می شود که الکترود کار
تا حد امکان به الکترود رفرنس نزديک باشد
vبرای کاهش مقاومت، الکتروليت حامل به محيط اضافه می شود
vاز لوله لاکچين استفاده می شود (به خصوص در محيط های آلی)
بیشتر





Reviews
There are no reviews yet.